近日,金沙8888js官方/泰康生命医学中心宋保亮团队在EMBO Journal 发表了题为GRAMD1/ASTER-mediated cholesterol transport promotes Smoothened cholesterylation at the endoplasmic reticulum的研究论文,揭示了GRAMD/ASTER家族蛋白介导质膜胆固醇运输进而调控内质网上SMO蛋白胆固醇化修饰的机制。

Hedgehog(Hh)信号通路对于胚胎发育及成体损伤组织、器官修复具有重要作用。在成年人中异常激活Hh信号通路与各种癌症的发生密切相关。Hh信号转导主要步骤包括:成熟形式的Hh蛋白与细胞质膜(PM)上的配体Ptched1(PTCH1)结合,解除PTCH1对Smoothened(SMO)的抑制,激活的SMO被转运到初级纤毛进而开启信号通路。
2017年4月,金沙8888js官方宋保亮教授团队在Molecular Cell上首次报道了SMO蛋白第95位天冬氨酸(D95)可被胆固醇共价修饰。这一修饰对SMO参与Hh信号转导至关重要,在小鼠中将SMO胆固醇修饰位点突变导致胚胎致死【1】。因此SMO是否被胆固醇化修饰是Hh信号传递的一个关键节点。
2022年2月,该合作团队在《细胞研究》上报道了在钙离子存在时,SMO胆固醇化修饰由自催化完成;Hh可以激活STIM-ORAI1钙离子通道,导致早期胞内体中钙离子含量增加,进而增加早期胞内体上SMO的胆固醇化修饰【2】。
内质网(ER)作为蛋白质初始合成场所,对于ER上SMO胆固醇化修饰的调控尚不清楚。ER中胆固醇含量低而钙离子含量丰富。当质膜(PM)游离胆固醇含量增加时,GRAMD家族蛋白可以被招募到ER-PM接触位点,进而将PM上游离胆固醇转运到ER【3】。
本研究发现:当用Hh蛋白处理细胞后,GRAMD可以被招募到ER-PM接触位点,并将PM上游离的胆固醇转运到ER,进而增加ER上SMO的胆固醇化修饰。胆固醇化修饰后导致SMO构象发生变化,使SMO蛋白C末端的基序(RRxWxR)暴露,COPII蛋白复合体识别并结合该基序将SMO转运至高尔基体,在高尔基体上SMO完成糖基化修饰,成熟形式的SMO进入初级纤毛,开启信号通路(图1)。本研究将细胞内胆固醇转运与Hh信号转导联系起来,为深入研究Hh信号通路提供了新的方向。
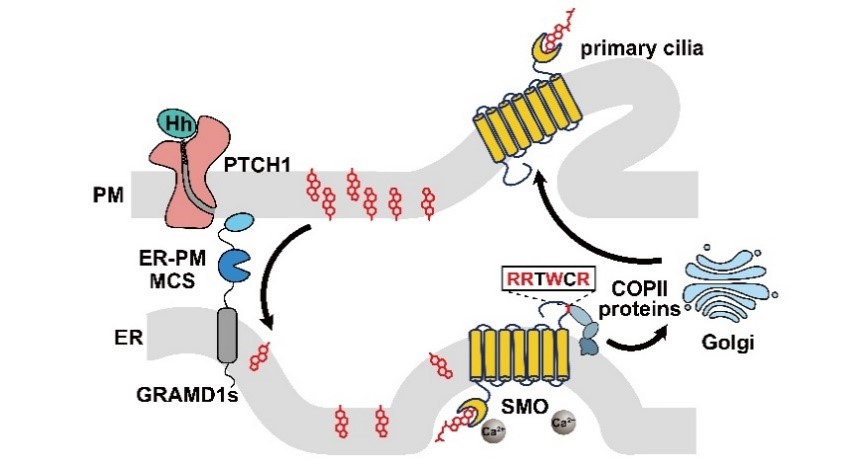
图1:Hh/PTCH1通过SMO调控信号通路的机制
金沙8888js官方邱智萍博士和林子存博士为本论文共同第一作者。宋保亮院士为通讯作者。该工作得到国家自然科学基金委,武汉大学的资助,宋保亮获腾讯科学探索奖资助。
原文链接:
https://www.embopress.org/doi/full/10.15252/embj.2022111513
参考文献
1. Xiao X, et al. (2017) Cholesterol Modification of Smoothened Is Required for Hedgehog Signaling. Molecular cell 66(1):154-162 e110.
2. Hu A, et al. (2022) Cholesterylation of Smoothened is a calcium-accelerated autoreaction involving an intramolecular ester intermediate. Cell research.
3. Sandhu J, et al. (2018) Aster Proteins Facilitate Nonvesicular Plasma Membrane to ER Cholesterol Transport in Mammalian Cells. Cell 175(2):514-529 e520.