线粒体是半自主性细胞器,具有独立于细胞核的遗传物质(线粒体DNA,mtDNA),mtDNA转录表达线粒体呼吸链复合物核心蛋白,对于细胞氧化磷酸化产生ATP至关重要。另外,在生理刺激及病理下,mtDNA可从线粒体释放至细胞质,引起细胞免疫应答。关于mtDNA的释放研究一直是线粒体领域国际前沿和热点,但具体机制复杂,目前很不清楚。
2022年3月21日,金沙8888js官方宋质银教授和人民医院麻醉科孟庆涛主任医师共同通讯在Hepatology《肝脏病学》在线发表题为“Loss of Sam50 in hepatocytes induces cardiolipin-dependent mitochondrial membrane remodeling to trigger mtDNA release and liver injury”(肝细胞中Sam50缺失诱导心磷脂依赖的线粒体膜重构去触发线粒体DNA释放和肝损伤)的研究论文,该研究发现Sam50缺失(或减少)引起的心磷脂外化是线粒体DNA释放的信号,揭示了线粒体DNA释放的新机制。
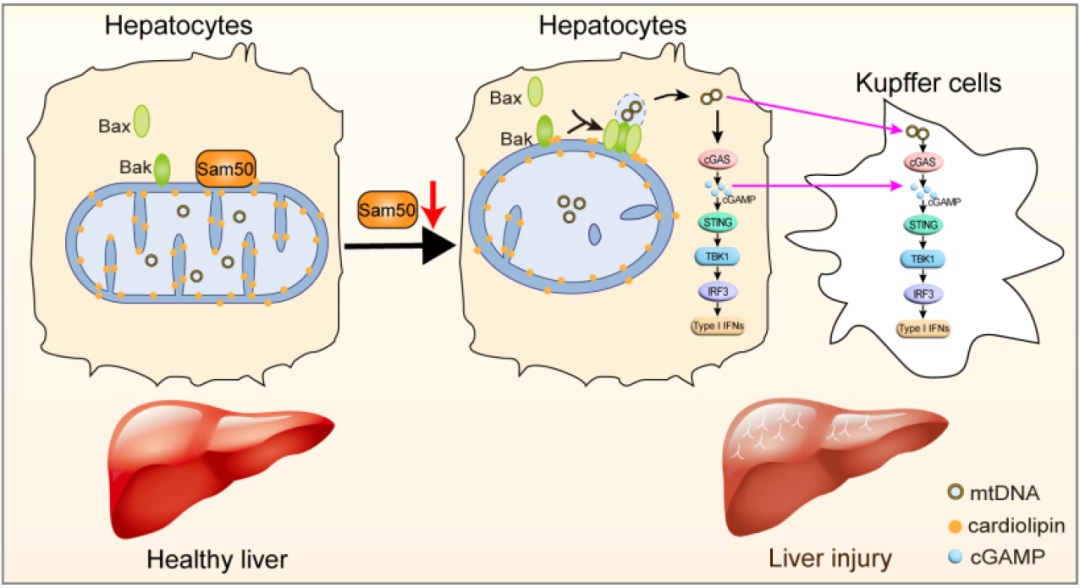
研究人员首先发现Sam50缺失的细胞中,mtDNA出现明显聚集现象,进一步研究发现在肝细胞特中特异性缺失Sam50会导致小鼠出现明显肝损伤症状。通过高通量测序发现Sam50缺失小鼠肝脏中IFN信号通路被明显激活,蛋白表达检测发现肝脏cGAS-STING信号通路被显著活化。如果抑制cGAS-STING通路明显缓解Sam50缺失所诱发的肝损伤表症。通过高分辨显微镜成像发现肝细胞Sam50的缺失会导致线粒体嵴重构并引发大量mtDNA释放到线粒体外。进一步的分子机制研究揭示,Sam50能通过调控心磷脂在线粒体膜的含量和分布调节线粒体膜结构;Sam50缺失会导致心磷脂外移(内膜至外膜),进而诱发Bax和Bak寡聚化,进一步诱导mtDNA的释放,释放的mtDNA可激活cGAS-STING信号通路,最终诱发小鼠肝损伤。更重要的是,在对乙酰氨基酚(acetaminophen,APAP)过量造成肝损伤的模型中,Sam50蛋白被显著下调,而在小鼠体内过表达Sam50蛋白能降低mtDNA释放进而缓解过量APAP处理所造成的肝损伤。值得指出的是,cGAS和STING蛋白在肝细胞中表达很低,但Sam50缺失可明显增加cGAS和STING表达量;另外,肝细胞内释放的mtDNA可转移至邻近的库普弗(kupffer)细胞,导致库普弗细胞内cGAS-STING信号通路也被激活。
综上所述,该研究发现心磷脂外化是一种新的mtDNA释放信号,揭示了mtDNA释放的新机制及其在肝损伤中所扮演的重要角色,并为治疗APAP肝毒性提供了新的潜在靶点和理论依据。
金沙8888js官方宋质银教授和人民医院麻醉科孟庆涛主任医师为共同通论作者,金沙8888js官方博士研究生陈丽和董君是论文的共同第一作者。该研究得到科技部重点研发计划、国家自然科学基金委面上等项目的资助支持。
论文链接:https://aasldpubs.onlinelibrary.wiley.com/doi/10.1002/hep.32471