继发现VP40调控埃博拉病毒由RNA合成向组装/出芽切换的分子机制后(Protein & Cell, 2020),近日, 国际学术期刊PLoS Pathogens在线发表了金沙8888js官方病毒学国家重点实验室陈明周/覃雅丽研究组的最新研究成果,论文题为 “P300-mediated NEDD4 acetylation drives ebolavirus VP40 egress by enhancing NEDD4 ligase activity”(P300介导NEDD4的乙酰化通过增强NEDD4连接酶活性驱动埃博拉病毒基质蛋白VP40的出芽: 论文链接https://doi.org/10.1371/journal.ppat.1009616)。该研究揭示了病毒利用蛋白质乙酰化修饰促进病毒出芽的新机制。
埃博拉病毒(EBOV)是引起人类和灵长类动物高致命性出血热疾病的重要病原体之一。2013-2016年在西非的暴发是迄今为止埃博拉病毒史上地理分布最广和持续时间最长的暴发,给国际公共卫生带来了巨大挑战。因此,深入揭示埃博拉病毒的发病机制以及与宿主细胞的关系对于研发新的疫苗和抗病毒药物显得尤为重要。
EBOV复制的最后阶段为病毒颗粒从宿主细胞中出芽释放,其中基质蛋白VP40是驱动病毒颗粒形成必不可少的结构蛋白。在过去的研究中已经发现一些蛋白质翻译后修饰通过不同的细胞信号转导机制调控VP40的出芽,例如泛素化、SUMO化和磷酸化等,但是乙酰化还未有报道。基于此,研究人员发现乙酰转移酶P300可以催化EBOV出芽的正调控细胞因子E3泛素连接酶NEDD4 的乙酰化,并发现其乙酰化位点为667位的赖氨酸。进一步,研究揭示了P300介导NEDD4的乙酰化增强了NEDD4与VP40的相互作用,提高了NEDD4的E3泛素连接酶活性,从而激活了VP40的泛素化,并最终帮助其出芽。在P300敲除的细胞中,扎伊尔型埃博拉病毒的出芽与野生型细胞中相比显著减少,这说明P300介导的乙酰化在埃博拉病毒生活周期中扮演重要的生理功能。该研究内容首次阐明了NEDD4的乙酰化调节自身的泛素化驱动埃博拉病毒出芽的作用机制,为蛋白质翻译后修饰在埃博拉病毒出芽方面的研究做了补充,并为合理寻找潜在的抗埃博拉病毒治疗靶点奠定了坚实的理论基础。
金沙8888js官方博士后张林亮为该论文的第一作者,陈明周教授和覃雅丽副教授为该论文的共同通讯作者。该研究得到了国家重点研发计划(2017YFA0505801)、国家科技重大专项(2018ZX10101004)、国家自然科学基金(81825015, 81871650, 31630086)和武汉国家生物安全实验室(P4)高端用户培养项目(2019ACCP-MS06)的联合资助。
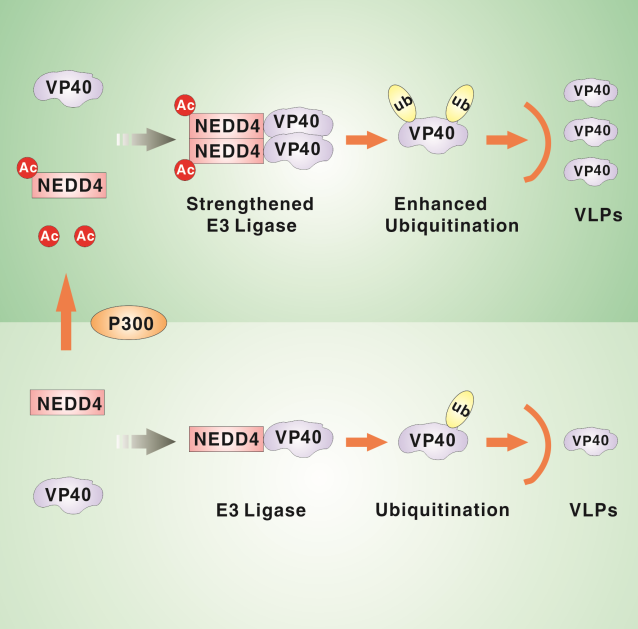
模式图:NEDD4的乙酰化驱动埃博拉病毒基质蛋白VP40的出芽