2020年6月8日,《Nature Structural & Molecular Biology》(《自然•结构与分子生物学》,IF=12.109)以长文(Article)形式在线发表金沙8888js官方细胞稳态湖北省重点实验室梁毅研究组在朊病毒蛋白纤维冷冻电镜结构研究取得的新成果,论文题目为“Cryo-EM structure of an amyloid fibril formed by full-length human prion protein”(全长人朊病毒蛋白纤维的冷冻电镜结构)。
由朊病毒蛋白(PrP)在体内发生错误折叠所导致的传染性海绵状脑病(又称prion疾病)是一种慢性并可在多种哺乳动物之间传播的致死性神经退行性疾病(Prusiner S. B. Proc. Natl. Acad. Sci. U.S.A. 1998, 95, 13363-13383;Soto C. Trends Biochem. Sci. 2011, 36, 151-158;Prusiner S. B. Science 2012, 336, 1511-1513;Scheckel C. and Aguzzi A. Nat. Rev. Genet. 2018, 19, 405-418)。1997年诺贝尔生理或医学奖得主Prusiner S. B.最先描述了朊病毒(prions),即蛋白质感染因子。Prion疾病的主要病理特征为PrP由细胞型朊蛋白(PrPC)转变为病理型朊病毒蛋白(PrPSc),PrPSc和PrP的淀粉样纤维可以作为模板诱导PrPC发生构象转变。然而由于PrPSc和PrP纤维的不溶性和异质性,目前仍无高分辨率的PrPSc和全长PrP纤维的结构(Diaz-Espinoza R. and Soto C. Nat. Struct. Mol. Biol. 2012, 19, 370-377;Gallagher-Jones M. et al. Nat. Struct. Mol. Biol. 2018, 25, 131-134;Spagnolli G. et al. PLoS Pathog. 2019, 15, e1007864)。
在朊病毒蛋白前期工作的基础上,武汉大学金沙8888js官方梁毅教授团队和中国科学院上海有机所生物与化学交叉研究中心刘聪教授团队、华中农业大学生命科学技术学院殷平教授团队合作,于2020年6月8日在Nature Structural & Molecular Biology杂志以长文(Article)形式发表论文,首次在原子水平上解析了全长朊病毒蛋白纤维的高分辨率冷冻电镜结构(2.70 Å),发现PrP纤维核心主要由其C端的170-229组成。朊蛋白纤维由两股原纤维以左手螺旋的方式缠绕而成,在朊蛋白聚集过程中,两股原纤维通过Lys194和Glu196之间形成的盐桥发生相互作用,在其相互作用的界面处形成了一个亲水腔。同时,对于这样新奇的结构,研究团队对于其病理学意义进行了探索,发现在PrP纤维结构中形成盐桥的三个关键氨基酸残基Lys194、Glu196和Glu211都是与prion疾病相关联的病理突变位点。这项工作的实验结果表明,在PrP错误折叠过程中,PrPC C端的两个α-螺旋转变成PrP纤维的β-折叠结构,Cys179和Cys214之间的二硫键起到了稳定淀粉样纤维结构的作用。上述研究在原子水平上揭示了PrP由PrPC向PrPSc结构转变的机制,启示不同的病理突变体在调节朊病毒蛋白构象转化中可能发挥着不同的作用,并使得发展新的基于PrP纤维结构的prion疾病治疗药物成为可能,具有重要的科学意义。

▲ 全长人朊病毒蛋白纤维的冷冻电镜结构

▲ 全长人朊病毒蛋白纤维的原子结构模型
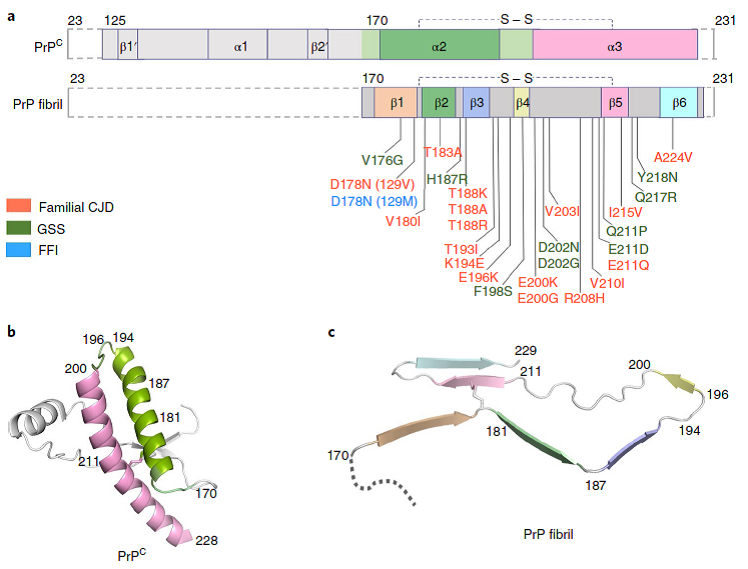
▲ 人野生型PrPC和PrP纤维结构比较
金沙8888js官方梁毅教授和中国科学院生物与化学交叉研究中心刘聪教授为本论文通讯作者,武汉大学金沙8888js官方2017级博士研究生王利强为第一作者,中国科学院上海有机所生物与化学交叉研究中心博士研究生赵焜为并列第一作者,武汉大学金沙8888js官方2020级博士研究生袁菡烨和华中农业大学生命科学技术学院殷平教授、博士研究生王强等参与了该论文的研究工作。该项工作得到了国家自然科学基金委和国家科技部的支持。
论文链接:https://www.nature.com/articles/s41594-020-0441-5