2018年11月8日,金沙8888js官方钟波教授作为通讯作者在国际权威期刊Cell Research (IF:15.3) 上在线发表题为“Induction of OTUD4 by viral infection promotes antiviral responses through deubiquitinating and stabilizing MAVS”(病毒感染诱导的OTUD4通过稳定MAVS的蛋白水平促进抗病毒免疫应答)的学术论文(论文链接:https://www.nature.com/articles/s41422-018-0107-6)。该文阐述了病毒诱导表达的去泛素化酶OTUD4通过去泛素化并稳定重要信号蛋白MAVS调控天然免疫应答的过程。金沙8888js官方2016级博士研究生刘雨田子为该论文的第一作者。
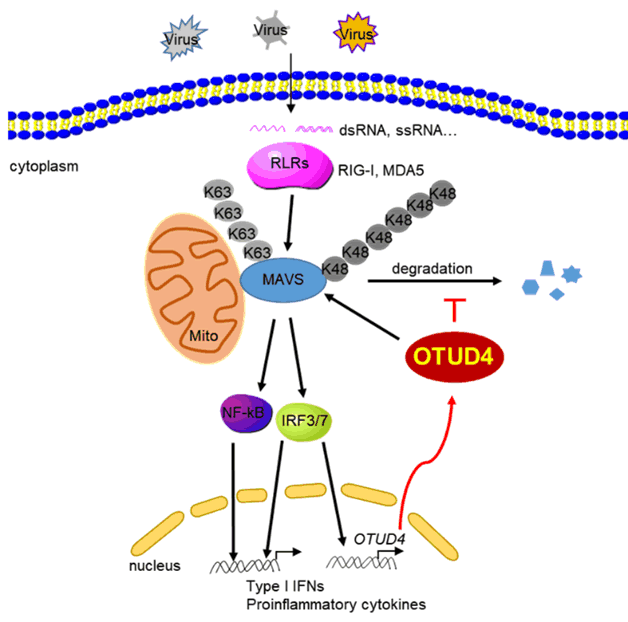
天然免疫是保护机体抵御病原微生物的入侵的第一道生理防线。其中MAVS(也称VISA)介导的信号通路在机体抗RNA病毒天然免疫应答的过程中扮演着重要角色,其功能受到多种翻译后修饰的严格调控,包括泛素化和去泛素化,但是之前的研究只报道集中在鉴定泛素化MAVS的E3泛素连接酶,对于MAVS是否存在去泛素化调控及其分子机制与生理学意义尚不清楚。该研究小组首次发现了重要信号蛋白MAVS的去泛素化酶OTUD4,发现OTUD4通过去MAVS的K48连接的泛素化修饰从而稳定MAVS,进而促进宿主抗RNA病毒天然免疫应答。已报道的研究结果表明OTUD4具备特异水解K48或K63链接的泛素链活性,该研究证实OTUD4调控MAVS的去泛素化过程依赖于其K48特异的去泛素化酶活性。在OTUD4敲除的细胞中,MAVS的K48连接泛素化修饰增强,使得MAVS通过泛素蛋白酶体途径降解,从而抑制了RNA病毒介导的IRF3和NF-κB的激活以及干扰素和炎症基因的表达。OTUD4条件性敲除的小鼠对于RNA病毒VSV易感,小鼠体内的病毒复制增强。此外,病毒感染上调OTUD4的表达,暗示着OTUD4在正反馈调控抗病毒免疫应答过程中起着关键作用。
该项研究依托于金沙8888js官方和武汉大学医学研究院,受到国家重大基础研究计划(973)、国家自然科学基金委青年项目、面上项目、优秀青年科学基金、湖北省自然科学基金以及武汉大学自主科研项目等项目的支持。