2017年3月27日,金沙8888js官方刘勇课题组在国际著名免疫学期刊《Nature Immunology》上在线发表了题为“Themetabolic ER stress sensor IRE1α suppresses alternative activation ofmacrophages and impairs energy expenditure in obesity”的研究成果。此项工作揭示了内质网应激感应蛋白IRE1α通过调控巨噬细胞的极性活化影响机体的能量平衡,在肥胖与相关代谢疾病的发生发展中发挥重要的功能。
巨噬细胞介导的慢性炎症是肥胖诱发胰岛素抵抗与2型糖尿病的关键环节。在代谢正常的脂肪组织中,存在大量处于替代性激活(又称M2极性激活)状态的巨噬细胞,通过抑制炎症的作用参与维持脂肪组织的胰岛素敏感性和代谢功能;而在营养过剩与肥胖发生过程中,白色脂肪组织中驻有大量侵润的处于经典激活(又称M1极性激活)状态的巨噬细胞,通过分泌各种炎性因子促进代谢性炎症的发生。在肥胖病人的代谢组织包括脂肪组织中,又同时呈现炎症与内质网应激(ER stress)并存的状况。真核细胞中,当内质网难以承担未折叠蛋白负荷或脂质代谢发生异常时,都会导致内质网应激,激活三条经典的未折叠蛋白响应(UPR,Unfolded Protein Response)通路,其中包括进化上高度保守的内质网应激感应分子IRE1通路。IRE1α是定位于内质网的跨膜蛋白,具有蛋白激酶与核酸内切酶的双重活性,能够在多种组织细胞中感应机体营养状况的变化,因此可能在能量平衡调节与代谢紊乱的发生发展中扮演重要的角色。
为了解析IRE1α通路与肥胖引发的内质网应激及代谢性炎症之间的机制关联,刘勇与段胜仲指导的博士研究生闪波、王晓霞和吴颖等构建了在髓性细胞(包括巨噬细胞)中特异敲除IRE1α的小鼠模型。在生理学水平上的研究发现,在高脂喂养条件下,髓性细胞中缺失IRE1α的小鼠能够通过增强棕色脂肪和米色脂肪的产热活性,抵御高脂诱导下肥胖的发生;同时该小鼠的胰岛素抵抗、高脂血症和脂肪肝等代谢紊乱症状明显改善。此外,伴随高脂喂养发生的M1巨噬细胞在白色脂肪中的侵润明显减少,而M2巨噬细胞却明显增多。进一步研究显示,巨噬细胞中IRE1α的缺失能够促进皮下白色脂肪的棕色化,进而增强机体产热消耗能量的能力。这些研究结果表明,在营养过剩状况下,IRE1α能够阻遏巨噬细胞的M2极性活化,进而诱发脂肪组织炎症、降低能量消耗,从而在破坏机体能量平衡的过程中发挥关键的作用;而特异性抑制巨噬细胞中的IRE1α通路,对于肥胖、胰岛素抵抗与2型糖尿病等代谢疾病的防治具有重要的转化潜力。
该项研究得到科技部重大研发计划、国家自然科学基金委重大与重点项目等基金的支持,并在相关研究方面得到国内外合作实验室的大力协助与支持。刘勇和段胜仲为该篇论文的共同通讯作者。
原文链接:http://www.nature.com/ni/journal/vaop/ncurrent/full/ni.3709.html
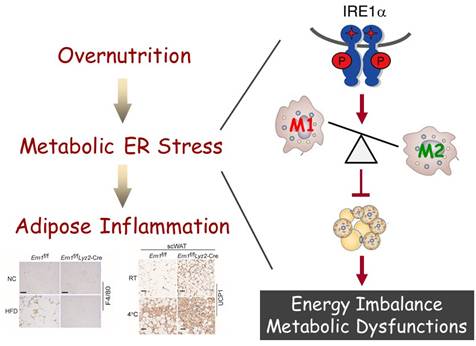
内质网应激IRE1α通路调控巨噬细胞的极性活化与能量平衡